[ISSUE&INSIGHT] 코로나19 백신 연구개발 현황과 전망
- 국가비전과 전략연구
- 위원회 및 연구단
- 발행기관경제ㆍ인문사회연구회
- 연구자김두진 한국생명공학연구원 선임연구원
주요내용

김두진 한국생명공학연구원 감염병연구센터 선임연구원
1. 역사 속 회자되던 감염병 재앙, 21세기 지구를 뒤덮다.
아테네 역병, 유스티니아누스 역병, 중세 유럽의 대흑사병, 런던 흑사병, 그리고 1918년 스페인 독감. 역사 속에서 ‘무서웠다더라’고 회자되던 감염병이 부활한 듯, 2020년의 인류는 ‘코로나19 시대’를 힘겹게 살아가고 있다. 코로나19는 2019년 12월, 중국 우한에서 처음 보고된 이래 무서운 속도록 전 세계로 퍼져 나고 있으며, 2020년 9월 7일 국제보건기구(WHO) 기준으로 2천 7백만명 이상의 확진자와 88만명의 사망자를 기록 중이다. 이에 전 세계는 모든 과학적, 정치적, 경제적 자원을 동원하여 이 신종 감염병에 대한 대응책을 강구하고 있다. 특히 백신은 최소한의 비용으로 감염병을 선제적으로 예방할 수 있다는 점에서 이번 코로나19, 그리고 인류가 또 겪을지도 모르는 감염병 대응을 위해 매우 중요하다.
2. 백신의 시작과 현재
1796년, 영국의 의사 에드워드 제너(Edward Jenner, 1749~1823)는 소의 질병인 우두(牛痘, cowpox)를 이용하여 천연두에 대한 면역을 얻을 수 있다는 사실을 발견하고 그 물질에 ‘백신(vaccinæ)’이라는 이름을 붙였다. 제너의 백신 기술은 전 세계로 전파되어 수많은 생명을 구했고, 천연두는 1977년 아프리카에서 마지막 한 명의 환자를 끝으로 인간 사회에서 자취를 감췄다. 결국 1980년 국제보건기구(WHO)는 공식적으로 천연두가 ‘박멸’ 되었음을 선언했다. 수천년 동안 인류가 가장 두려워했던 질병인 천연두가 인류가 정복한 첫 번째 질병이 되는 역설적이고도 기쁜 순간이었다.
과학이 발달하며 사람들은 ‘우두 성분의 천연두 예방약’을 의미하던 ‘백신’의 의미를 점점 넓혀갔다. 현대 의학에서 백신은 ‘병원성을 제거하거나 약화시킨 병원체 또는 병원체의 일부로, 인체에 투여되었을 때 항원 특이적인 면역반응(항체 또는 T 세포)을 유도할 수 있는 물질’을 의미한다. 그 정의에서 알 수 있듯, 현재까지 개발된 백신은 병원체(세균, 바이러스 등)를 불활화(inactivation) 또는 약독화(attenuation)하여 제조하거나, 또는 병원체로부터 주요 항원(단백질 또는 당 분자)만 정제하여 사용하고 있다. 단백질 항원의 경우 분자생물학 기술을 이용하여 항원을 인공으로 제조하여 사용하기도 한다. 2019년 10월 질병관리본부 기준 국내에 허가되어 유통되는 예방백신은 총 25종이며 (질병의 종류가 아닌 백신의 종류) 제품으로는 40종류가 넘는다(질병관리본부, https://nip.cdc.go.kr/irgd/introduce.do?MnLv1=1&MnLv2=5).
3. 시험대에 오른 다양한 백신 기술들
제너가 처음 백신을 발견한 지 200년이 넘게 흘렀다. 그 동안 인류는 거의 무(無)에서 유(有)를 창조하듯 눈부신 과학기술의 발전을 이룩했고, 여기에 발맞춰 생명과학 기술도 진일보하며 다양한 백신 기술이 개발됐다. 코로나19라는 전대미문의 사태를 겪으며 세계 곳곳에서 자신들이 보유한 백신 기술을 이용하여 다양한 기반의 코로나19 백신 개발에 박차를 가하고 있다.
많은 바이러스 백신이 그러하듯, 코로나19 백신도 바이러스가 숙주세포에 감염할 때 사용하는 단백질을 주요 표적 항원으로 개발되고 있다. Spike라는 돌기 형태의 바이러스 단백질이다. 백신 접종에 의해 B 세포가 활성화되고, 이에 따라 형성된 spike-특이적인 항체가 바이러스의 숙주세포 수용체 결합을 방해하는 원리다. 또한 백신은 T 세포 면역반응을 유도하여 감염된 세포를 제거하거나, 항체반응의 질과 양을 향상하는데 도움을 줄 수 있다. 문제는 백신이 이런 반응을 얼마나 효과적으로, 안전하게 유도할 수 있는가 이고, 이것을 위해 수많은 연구자와 기업들이 다양한 기반기술을 활용하여 개발 경쟁에 뛰어들고 있다 [그림 1].
[그림 1] 코로나19 바이러스(SARS-CoV-2)의 유전자 구조와 다양한 코로나19 백신 기반기술 모식도 (Immune Network. 2020 Aug;20(4):e28에서 발췌, 변형. (https://doi.org/10.4110/in.2020.20.e28))
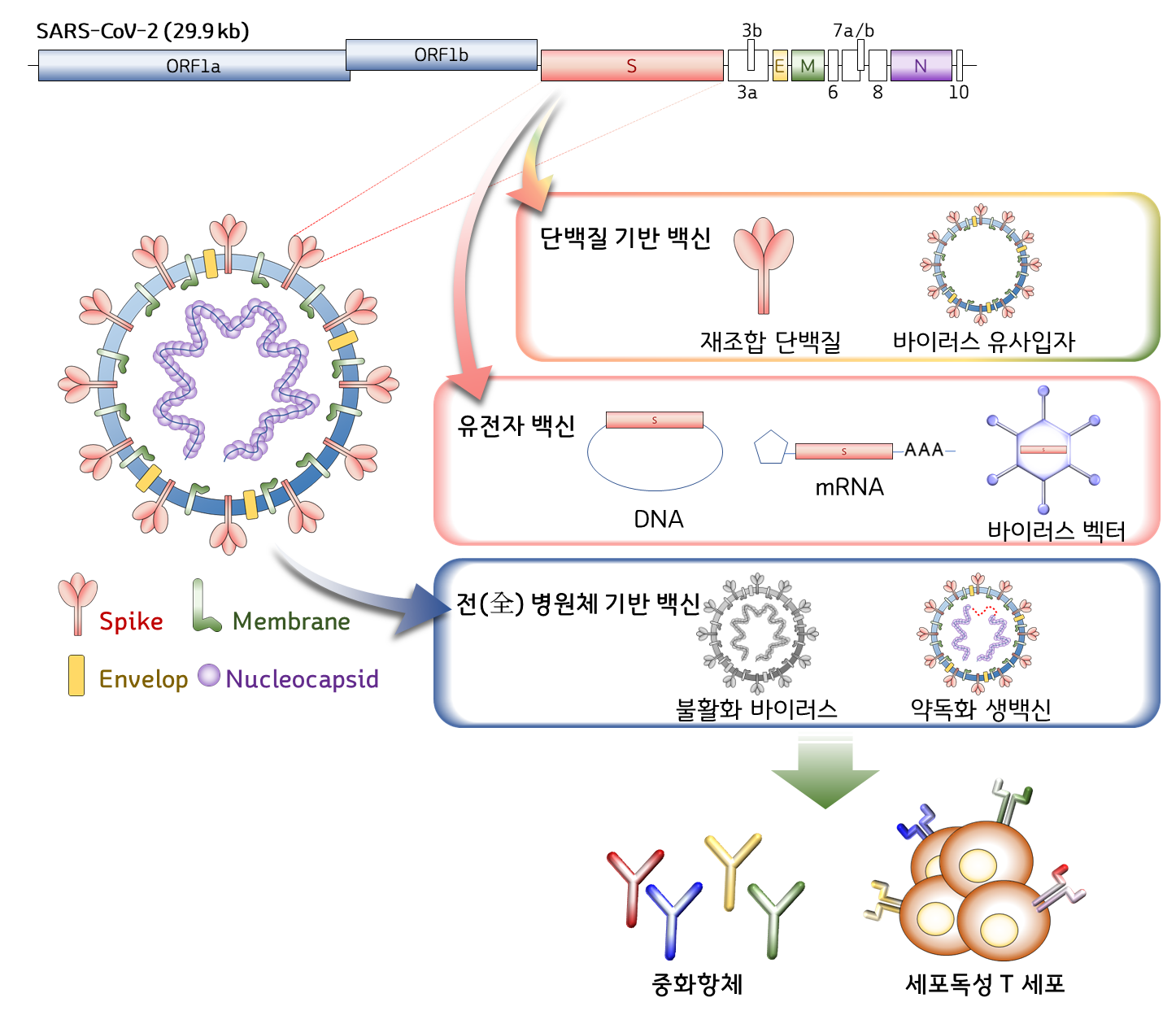
불활화 바이러스 백신 (Inactivated virus vaccine)
불활화 바이러스는 병원체 바이러스를 배양한 후, 유기용매, 열, 자외선, 계면활성제 등으로 바이러스를 사멸하여 제조한다. 바이러스 증식만 양호하다면 비교적 저렴한 비용으로 빠른 시간 내에 개발 및 대량생산이 가능하다. 면역원성 및 백신의 효능도 비교적 높은 편이고, 면역증강제(adjuvant)를 첨가하여 효능을 더 높일 수도 있다. 그러나 바이러스 배양 조건이 확립되지 않았거나 수율이 낮을 경우 개발 및 대량생산이 어렵고, 고위험 바이러스의 경우 생산시설의 생물안전 유지에 많은 비용과 노력이 필요하다. 소아마비, A형간염, 인플루엔자 등의 백신이 이 기술로 제조된다. 임상시험 단계에 있는 코로나19 백신 34개 후보물질 중, 6개가 이에 해당된다 (표 1, 9월 8일 기준).
약독화 생백신 (Live attenuated virus vaccine)
약독화 생백신은 바이러스를 오랜 시간 계대배양(연속배양)하여 바이러스 유전자에 변이 또는 소실이 일어나 병원성이 낮아진 살아있는 바이러스이다. 살아있는 바이러스이기 때문에 실제 감염과 유사한 반응을 일으키고, 그런 이유로 백신의 효능이 매우 우수하다는 장점과, 면역력이 약한 사람에게 부작용을 일으킬 수 있다는 단점을 동시에 갖고 있다. 수두, MMR(홍역, 볼거리, 풍진 혼합백신) 등이 이에 해당한다. 코로나19의 경우 고위험 병원체이기 때문에 현재 약독화 생백신으로 개발은 이루어지지 않고 있다. 안전성 문제가 해결된다 하더라도 약독화 바이러스를 얻기까지 장기간 계대배양이 필요하기 때문에 현재 상황에는 적용하기 어렵다.
재조합 단백질 백신 (Recombinant protein vaccine)
재조합 단백질 백신은 비교적 오랜 기간에 걸쳐 연구, 개발되어 효능과 안전성이 검증된 기술이다. 바이러스 감염에 중요하게 작용하는 특정 단백질 항원을 동물세포, 곤충세포, 효모 등에서 생산한 뒤, 대부분의 경우 면역증강제와 혼합하여 만든다. 이하의 모든 재조합 기술 기반 백신들과 동일하게 완제품은 물론 생산 공정에도 살아있는 병원체 바이러스가 포함되지 않는다. 또한 대량생산 시설을 이미 갖추고 있는 기업들에게는 기존 설비를 그대로 이용할 수 있다는 추가적인 장점도 있다. B형 간염 백신, 미국에서 허가된 인플루엔자 백신(Flublok) 등이 이에 속하고, 코로나19 백신 11개 후보물질이 임상 연구단계에 진입해 있다 [표 1].
바이러스 유사입자 (Virus-like particle, VLP) 백신
바이러스는 아니지만 마치 바이러스와 유사한 모양으로, 바이러스 외피(envelop)를 구성하는 단백질 유전자만 사용하여 동물 또는 식물 세포에서 생산한다. 기본적으로 재조합 단백질 백신의 표적 항원도 갖고 있으면서 실제 바이러스와 유사한 크기와 구조를 갖기 때문에 우리 몸의 면역체계가 더 잘 인식한다는 장점이 있다. 인유두종바이러스(human papillomavirus, HPV)에 의한 자궁경부암을 예방하는 자궁경부암 예방백신이 시판되고 있으나, 이 바이러스의 경우 외피가 없기 때문에 생산 과정 측면에서는 재조합 단백질 백신 기술에 더 가깝다. 반면 외피가 있는 바이러스에 대한 바이러스 유사입자 백신은 아직까지 인체용으로 승인된 적이 없고, 생산 수율이 타 백신에 비해 낮다는 단점이 있다. 코로나19 백신으로 한 개가 임상단계 연구 중이다 [표 1].
DNA 백신, RNA 백신
주요 항원을 단백질이 아닌 DNA 또는 RNA 형태로 제조하여 투여하는 방법이다. 투여된 유전자로부터 체내에서 항원 단백질이 만들어지고, 이에 대한 면역반응이 유도된다. 유전자 정보만 있으면 빠른 개발이 가능하고 대량생산도 용이하기 때문에 신변종 감염병 대응을 위한 차세대 백신 기술로 주목받고 있다. 항체반응과 세포성 면역반응을 동시에 유도할 수 있다. DNA 백신의 경우 오랜 연구를 거쳐 물질 자체의 안전성을 입증 받았기 때문에 비임상 독성연구가 면제될 수 있어 더욱 빠른 개발이 가능하다. 그러나 이러한 핵산 백신으로 아직까지 승인받은 인체용 백신이 없으며, DNA 백신의 경우 백신 투여에 일반 주사기가 아닌 전기자극 또는 압력을 가하는 특수 장비가 필요하다. 대규모 접종을 위해 해결해야 할 문제다. 현재 DNA 백신 4종, RNA 백신 6종 후보물질이 임상단계 평가 중이다 [표 1].
바이러스 벡터 (Viral-vectored) 백신
앞선 DNA, RNA 백신과 동일하게 항원 유전자를 사용하는데, 인체에 무해한 다른 바이러스를 매개로 유전자를 전달하는 기술이다. 항체반응과 세포성 면역반응을 모두 강하게 유도하기 때문에 타 백신에 비해 높은 효능을 기대할 수 있다. 아데노바이러스나, 우두 바이러스, 홍역 바이러스 등의 병원성을 제거하여 전달체로 사용한다. 2019년 겨울, 수포성 구내염 바이러스(vesicular stomatitis virus, VSV)를 이용한 에볼라 백신이 미국에서 승인을 받아 바이러스 벡터를 이용한 인체용 감염병 백신의 첫 사례가 되었다. 아데노바이러스 벡터의 경우 전달 효율을 높이기 위해 개량된 인간아데노바이러스나 침팬지 유래 아데노바이러스를 사용하는 경우가 많으며, 에볼라 백신 임상 등에서 그 효능과 안전성이 입증된 바 있다. 그러나 인체에 무해한 바이러스 벡터를 사용한다 하더라도 체내 감염이 수반되기 때문에 개인의 체질이나 건강 상태에 따라 부작용이 나타날 우려가 있고, 실제로 에볼라 백신 개발 중에 관절염 등의 부작용이 나타난 바 있다. 코로나19 백신 후보로 비증식성 아데노바이러스 벡터 기반 5종, 홍역 바이러스 벡터 기반 1종이 임상시험 중이다 [표1].
[표 1] 코로나19 주요 백신 개발 현황*
|
개발사/제조업체 |
백신 플랫폼 |
임상시험 단계 |
|||
|
1상 |
1/2상 |
2상 |
3상 |
||
|
University of Oxford/AstraZeneca |
Non-Replicating Viral Vector |
|
O |
O |
O |
|
CanSino Biological Inc./Beijing Institute of Biotechnology |
Non-Replicating Viral Vector |
O |
|
O |
O |
|
Gamaleya Research Institute |
Non-Replicating Viral Vector |
|
|
|
O |
|
Janssen Pharmaceutical Companies |
Non-Replicating Viral Vector |
|
O |
|
O |
|
Sinovac |
Inactivated |
|
O |
|
O |
|
Wuhan Institute of Biological Products/Sinopharm |
Inactivated |
|
O |
|
O |
|
Beijing Institute of Biological Products/Sinopharm |
Inactivated |
|
O |
|
O |
|
Moderna/NIAID |
RNA |
O |
|
O |
O |
|
BioNTech/Fosun Pharma/Pfizer |
RNA |
|
O |
|
O |
|
Novavax |
Protein Subunit |
|
O |
O |
|
|
Anhui Zhifei Longcom Biopharmaceutical/Institute of Microbiology, Chinese Academy of Sciences |
Protein Subunit |
O |
|
O |
|
|
Curevac |
RNA |
O |
|
O |
|
|
Institute of Medical Biology, Chinese Academy of Medical Sciences |
Inactivated |
O |
O |
|
|
|
Research Institute for Biological Safety Problems, Rep of Kazakhstan |
Inactivated |
|
O |
|
|
|
Inovio Pharmaceuticals/ International Vaccine Institute |
DNA |
|
O |
|
|
|
Osaka University/ AnGes/ Takara Bio |
DNA |
|
O |
|
|
|
Cadila Healthcare Limited |
DNA |
|
O |
|
|
|
Genexine Consortium |
DNA |
|
O |
|
|
|
Bharat Biotech |
Inactivated |
|
O |
|
|
|
Kentucky Bioprocessing, Inc |
Protein Subunit |
|
O |
|
|
|
Sanofi Pasteur/GSK |
Protein Subunit |
|
O |
|
|
|
Arcturus/Duke-NUS |
RNA |
|
O |
|
|
|
ReiThera/LEUKOCARE/Univercells |
Non-Replicating Viral Vector |
O |
|
|
|
|
Clover Biopharmaceuticals Inc./GSK/Dynavax |
Protein Subunit |
O |
|
|
|
|
Vaxine Pty Ltd/Medytox |
Protein Subunit |
O |
|
|
|
|
University of Queensland/CSL/Seqirus |
Protein Subunit |
O |
|
|
|
|
Medigen Vaccine Biologics Corporation/NIAID/Dynavax |
Protein Subunit |
O |
|
|
|
|
Instituto Finlay de Vacunas, Cuba |
Protein Subunit |
O |
|
|
|
|
FBRI SRC VB VECTOR, Rospotrebnadzor, Koltsovo |
Protein Subunit |
O |
|
|
|
|
West China Hospital, Sichuan University |
Protein Subunit |
O |
|
|
|
|
Institute Pasteur/Themis/Univ. of Pittsburg CVR/Merck Sharp & Dohme |
Replicating Viral Vector |
O |
|
|
|
|
Imperial College London |
RNA |
O |
|
|
|
|
People's Liberation Army (PLA) Academy of Military Sciences/Walvax Biotech. |
RNA |
O |
|
|
|
|
Medicago Inc. |
VLP |
O |
|
|
|
* 자료출처: 세계보건기구(World Health Organization, https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines, 9월 8일 기준)
4. 백신이 코로나19를 종식시킬 수 있을까?
우리는 위와 같은 기술에 기반한 다양한 코로나19 백신 후보물질을 개발중에 있다. 그에 따른 당연한 질문은, 저 기술로 개발된 백신이 과연 코로나를 종식시킬 수 있을까 하는 것이다. 코로나19 관련 연구는 지금까지의 어떤 연구 주제보다 빠르게 진전되며, 그 내용이 학술지뿐 아니라 언론을 통해서도 대중에 소개되고 있다. 그런데 객관적으로 해석되고 후속 연구로 이어져야 할 이런 과학적 발견들이 일부 매체를 통해 과장, 확대해석 되는 일이 빈번하게 일어나는 듯하다. 이는 성공적인 백신 개발을 기다리며 코로나19를 힘겹게 헤쳐 나가는 사람들에게 비관론을 가져왔고, 코로나19 백신 개발이 실패하거나, 나오더라도 코로나를 종식시키지 못할 것이라는 의견은 관련 기사 댓글이나 유튜브 등 개인 매체를 통해 어렵지 않게 찾을 수 있다. 비관론을 가져온 사실들과, 그에 대한 오해를 과학적 사실에 근거해서 풀어보고자 한다.
바이러스가 계속 변이를 일으킨다?
코로나19 유행 초기, 중국을 포함한 아시아 지역에서는 S, V 그룹(clade라는 용어를 사용하는 것이 더 정확하다)이 유행했다. 우리나라도 4월 이전에 분리된 바이러스가 여기에 속한다. 반면 유럽과 북미에서는 GH 그룹이 유행했으며, 우리나라도 4월 수도권 집단감염부터 거의 GH 그룹으로 바이러스가 변해 갔다. 설상가상으로 GH 그룹은 바이러스의 세포 감염 능력이 기존에 비해 최대 6배까지 높고 세포에서 증식 속도도 더 빠르다고 보고되었다. 이런 사실은 코로나19가 RNA 바이러스로 변이 속도가 빠르다는 과학적 근거에 힘입어, 백신이 개발되더라도 바이러스 변이에 의해 결국 ‘물백신’이 될 것이라는 비관론을 낳았다. 사실은 어떠할까?
첫째, 코로나19 바이러스를 포함한 코로나바이러스는 RNA 바이러스로 DNA 바이러스에 비해 유전자 변이 속도가 매우 빠른 것이 사실이다. 하지만 불행 중 다행으로 RNA 바이러스 중에서는 변이가 가장 느린 축에 속한다. 인플루엔자 바이러스의 절반, HIV의 1/4 수준이라고 얘기한다. 이는 코로나바이러스가 유전자 복제 중에 생긴 오류를 ‘교정(proofreading)’할 수 있는 기능을 갖고 있기 때문이고, 다른 RNA 바이러스에서는 발견되지 않는 특징이다. 실제로 그 교정을 담당하는 유전자 exonuclease N(exoN)을 제거한 사스 코로나바이러스를 만들었을 때, 유전자 변이 빈도가 열 배 이상 높아지는 것이 보고된 바 있다. 코로나바이러스의 이런 특징은 핵산 유사체(nucleoside analogue)를 이용한 항바이러스제 개발에는 난관이 되지만, 백신 개발에 있어서는 우리에게 유리한 측면이다. 코로나19 백신의 성공을 100% 보장은 못하지만, HIV나 뎅기, HCV 등의 바이러스보다는 ‘해볼만 한’ 바이러스다.
둘째로, 모든 변이체가 백신이 제공하는 면역반응의 범주를 벗어나는 것은 아니다. 백신에 의해 우리 몸 속에서 형성된 항체는 spike의 특정 한 지점만을 인식하는 것이 아니라 여러 부위를 인식하는 수많은 종류의 다클론(polyclonal) 항체다. 설령 한 곳의 변이로 인해 그 부위에 대한 항체가 효력이 없어져도, 다른 부위에 대한 항체는 여전히 작용할 수 있다. 또한 백신은 항체 외에도 T 세포 매개 면역반응을 유도한다. T 세포는 항체의 생성을 도와주거나 감염된 세포를 직접 죽이는 역할을 하는데, 이때 이들은 항체가 인식하는 부위와 전혀 관계없는 서열을 전혀 다른 기전으로 인식한다. 따라서 세포성 면역반응을 유도하는 백신은 다양한 아형 또는 타입의 바이러스에 대해 항체보다 폭넓은 면역반응을 제공할 수 있다. 위에 언급된 코로나19 백신 후보물질 중 일부는 T 세포 면역반응을 강하게 유도할 수 있어 바이러스 변이에 대한 우려를 덜어줄 것으로 기대된다.
셋째로 바이러스의 변이에는 한계가 있다. 코로나19 바이러스는 숙주세포의 ACE2 수용체에 결합하여 감염하는데, 면역반응을 회피하는 과정에서 spike 서열 중 일부 변화가 일어날 수 있다. 하지만, 결합에 필수적인 아미노산마저 바뀌게 되면 세포 감염 능력이 떨어지는 변이체가 되고, 결국 이런 변이체는 자연적으로 도태된다. 실제로 국내 메르스 환자에서 분리된 바이러스가 기존에 알려진 몇몇 단클론 항체를 회피하는 변이체로 밝혀졌으나, 감염 능력 또한 떨어지는 것이 확인된 바 있다.
코로나19 감염 후 회복된 사람들 몸 속의 항체가 잘 생기지 않거나 매우 빨리 감소한다?
최근, 코로나19 회복된 환자 혈액의 중화항체를 검사하여, 세 달 정도 지나면 상당한 양의 항체가 감소한다는 연구 결과가 나왔다. 이 사실이 보도되면서 일부 사람들은 ‘집단면역은 물 건너 갔다.’라는 반응을 보였다. 당연히 백신 개발에 대해서도 회의적인 반응을 보였다.
하지만 이것은 매우 자연스러운 현상이다. 우리 몸의 면역반응은 병원체가 들어오면 항원 특이적인 T세포와 항체를 만들어 내는데, 급성 바이러스 감염일 경우 10일~2주 정도에 그 최고점에 달했다가, 바이러스가 사라지면 일부 면역기억 세포만 남기고 감소한다. 면역기억 세포는 혈액이나 면역기관, 또는 조직에서 평상시 조용한 상태로 머물다가, 동일한 항원의 2차 감염이 일어날 경우 빠르게 반응하는 세포다. 때문에 활발한 B 세포(정확하게는 B 세포에서 분화된 plasma cell)로부터 이미 분비된 항체는, 그 공급원이 사라진 상태에서 서서히 줄어들 수밖에 없다. 더구나 언론에서 소개한 연구는 경증 감염자만을 대상으로 한 연구였다. 일반적으로 면역반응은 바이러스 감염의 세기와 지속기간, 질병의 중증도에 비례하는 경향을 보인다. 많이 아프면 항체가 많고, 가볍게 앓고 지나가면 항체도 적다. 경증 환자가 낮은 농도의 항체를 지니고, 바이러스가 사라진 3개월 후에 감소한 것은 급성감염 바이러스에 대한 면역반응으로 지극히 자연스러운 현상이다. 우리 몸의 면역체계는 침입한 병원체가 사라졌는데 비상 전시상황과 동일한 수준으로 군대를 유지하는 행동을 하지 않는다. 연구 저자들 역시 이 현상을 근거로 백신에 대한 비관론을 편 적이 없으며, 다만 혈중 항체값을 근거로 면역 획득을 판별하는 ‘immune passport’의 잣대로 활용하기 어렵다는 의견을 달았다.
다른 한 연구에서는 중심체(germinal center)라는 해부학적 구조가 코로나19 환자에서 나타나지 않는다고 보고했다. 이 중심체는 2차 면역기관인 비장, 림프절 등에 형성되는 구조로, 항체 형성에 중요한 B 세포가 활발히 증식하는 동시에 항원에 대한 친화력(affinity)을 점점 더 높이는 교육 기관이다. 이것이 없다는 것은 코로나19 감염 환자에서 나오는 항체가 매우 질이 낮고, B 세포도 단명(短命)할 가능성을 의미한다. 역시나 백신, 면역 비관론을 낳기에 좋은 정보로 보인다. 하지만 그 연구자들은 이것이 소수의 중증 환자에서만 나타난 현상임을 밝혀 성급한 일반화에 분명한 선을 그었으며, 이런 현상이 코로나19에 국한된 것이 아니라 에볼라, 마버그, H5N1 인플루엔자 등 중증 환자에서 공통적으로 관찰되었음을 설명했다.
완치 후 재감염 사례가 있다?
코로나 유행 초기부터 재감염 이야기는 심심치 않게 전문가들과 세간에 오르내렸다. 특히 방역당국에게 이 문제는 방역 지침을 정하는 데 매우 중요했다. 초기에 보고되었던 재감염 판정은 살아있는 바이러스가 아닌 바이러스 유전자의 잔해에 의한 위양성이거나, 몸 속 남아있던 바이러스가 일시적으로 재활성화 되면서 관찰된 현상인 것으로 일단락되었다. 하지만 최근 홍콩에서 30대 남성이 코로나19에서 회복한 후 5개월 만에 다른 그룹의 코로나19에 감염된 것이 확인되면서 백신 무용론이 또 고개를 들고 있다.
속단하기는 이르지만, 지금까지 확진자 2천 9백만 명, 그 중 회복한 2천만 명 중 유일한 사례인 점, 더욱 중요한 것은 지난 3월에는 약한 증상이 있었지만 이번 감염에는 증상이 전혀 없는 점 등을 눈여겨 볼 필요가 있다. 흔히 백신을 맞거나 질병을 앓아서 면역이 있다고 하면, 바이러스가 체내에 들어오는 즉시 항체에 의해 중화되는 이상적인 결과를 생각한다. 이것을 멸균면역 또는 살균면역(sterilizing immunity)이라 부른다. 최상의 시나리오지만 모든 사람이 이 수준의 면역을 갖는 것은 아니다. 특히 코로나19가 침투하는 점막에 중화항체 양이 충분하지 않을 경우, 바이러스는 일차적으로 호흡기 점막 감염을 일으킨다. 엄밀히 말해 ‘감염’이고, 바이러스 잔해 RNA 조각도 검출되는 지금의 기술로 진단될 수도 있다. 하지만 위에 언급한 우리 몸 속의 면역기억이 매우 빠르게 재활성화 되면서 더 이상의 바이러스 증식과 감염을 억제하게 되고, 우리는 별다른 증상 없이 그 질병을 이겨낼 수 있다. 만약 위 재감염 사례가 이런 것이라면, 지금과 같은 대대적인 진단이 이루어지지 않는 평소에는 감염 사실 자체도 모른 채 지나갔을 일이다. 이런 과정으로 재감염을 막아낸 상태인지, 정말 면역력이 소실된 상태에서 우연히 무증상 감염이 된 것인지는 추가적인 연구가 필요하다.
세 가지 백신 무용론, 비관론에 대한 과학적 사실을 살펴보았다. 조금은 희망을 가져도 될 것 같은 소식이다. 그렇다고 해서 섣부른 낙관론을 펴는 것은 위험하다. 성공적인 백신을 개발 했음에도 여전히 많은 감염병이 여전히 우리 주변을 맴돌고 있고, 우리가 가진 백신 중 대부분이 100% 효능을 보장하지 못한다. 그 공백을 어떻게 채울 수 있는지는 지금까지 개발된 모든 백신에 남아있는 과제다. 효능이 높고 안전한 백신이 나온다 하더라도 백신에 의한 바이러스 변이 또한 조심스럽게 우려된다. 앞서 코로나바이러스 변이의 한계에 대해 언급한 것과 모순될 수도 있지만, 지금 우리가 사용하는 모든 백신과 항생제는 미생물에 대한 선택압(selection pressure)으로 작용하고 있다. 백신이 전 세계 모든 인구에 동시에 투여될 수 없는 상황에서, 장기적으로 백신의 면역을 회피하는 변이가 생겨날 가능성은 여전히 남아 있다. 누구도 속단할 수 없는 지금의 상황에서는 근거 없는 비관론, 섣부른 낙관론 보다 신중한 판단과 기다림이 필요하다.
5. 백신 확보를 위한 노력
앞서 다룬 내용은 과학자들의 고민이지만, 백신은 과학자만이 고민해서 얻어낼 수 있는 것이 아니다. 더구나 지금 코로나19 상황에서는 더욱 그렇다. 특히 막대한 비용과 긴 시간이 필요한 임상시험, 대량생산과 보급은 지금 같은 비상 상황에서 특정 연구 그룹이나 단독 기업이 감당하기엔 버거운 일이다. 이를 위해 각국 정부와 국제기구, 사설 국제 단체 등은 필사적인 노력을 기울이고 있다. 우리 나라 정부도 연구지원, 개발지원, 심사, 국제적 공조를 통한 백신확보 등 다양한 측면에서 백신 자체개발 및 확보를 위해 노력하고 있다.
정부는 코로나19 유행 초기부터 보건복지부 및 과학기술정보통신부, 식품의약품안전처, 질병관리본부 등 관계부처와 치료제, 백신 분야 전문가로 구성된 ‘코로나19 치료제·백신 개발 범정부지원위원회’와, 산하 ‘실무추진위원회’를 구성했다. 이를 통해 각 분야 실무 전문가들의 의견을 수렴하여 정책 결정에 적극적으로 반영하고 있으며, 그 결정사항은 다시 현장으로 전달되어 국내 백신 개발 및 확보를 위한 길잡이가 되고 있다. 그 첫번째 일환이 백신 개발 및 연구 지원 확대이다. 국내 개발 선두에 있는 기업을 선정하여 임상연구 비용을 지원하기로 결정하였고 (확정 1개사, 예비선정 2개사), 출연연 및 국책연구단을 중심으로 영장류 및 설치류 전임상 효능평가와 비임상 독성시험을 지원하고 있다. 이런 지원 구조는 선두 그룹의 개발 속도를 높이면서, 동시에 후속 후보물질에 대한 꾸준한 지원을 통해 다양한 기술을 확보할 수 있다는 장점이 있다. 두번째로, 이렇게 개발된 후보물질의 빠른 임상시험 진입을 위해 식품의약품안전처를 통한 신속한 심사제도도 운영하고 있다. 미국의 경우 DNA 백신은 오랜 연구를 통해 그 물질의 안전성이 입증되어 비임상 독성을 수행하지 않는다. 국내 규제기관도 이러한 기조에 발맞추어 국내 개발 DNA 백신 후보물질에 대한 비임상 독성시험을 유보하고 임상시험을 승인하는 방향으로 결정을 내렸다. 국내에서 DNA 백신 임상이 빠르게 시작될 수 있었던 이유다. 또한 현재 식약처는 ‘코로나19 전담심사팀’을 설치하여 코로나19 백신 및 치료제의 임상 승인 심사에 있어 최우선 순위를 두고 있으며, 수시 상담을 통해 백신 개발의 지침을 전달하고 있다. 또한 범정부 차원의 백신 개발 기업 및 연구자를 위한 소통 창구도 개설됐다. ‘코로나19 대응 임상시험 지원 TF’, ‘기업 애로사항 해소 지원센터’ 등을 통해 백신 개발 연구 수행 중 생기는 문제를 상시적, 즉각적으로 해결할 수 있다.
코로나19는 국지적 또는 일부 인구의 문제가 아니다. 따라서 국가간 백신 확보 경쟁도 매우 치열할 것으로 예상된다. 이를 위해 국제적으로 COVAX Facility라는 시스템이 갖추어졌다. 이것은 백신 구매 능력을 갖춘 국가들이 재정을 확보하여 백신을 공동 구매, 분배하는 제도로, 전체 인구의 20% 접종을 목표로 하고 있다. 세계보건기구(WHO), CEPI(Coalition for Epidemic Preparedness Innovations, 감염병혁신연합), GAVI(Global Alliance for Vaccines and Immunisation, 세계백신면역연합)등 국제기구 및 국제기금 단체가 주도하는 프로그램이다. 우리나라 정부도 이 프로그램에 참여하기로 결정했고, 전 국민 또는 최소 70% 이상의 국민이 접종할 수 있는 물량 확보를 목표로 하고 있다. 국제기구를 통한 확보 노력 외에도 기업간의 계약에 의한 물량 확보도 추진 중이다. 국내 한 기업에서 영국 및 미국에서 개발한 바이러스 벡터 백신과 재조합 단백질 백신을 생산하는 내용의 협력의향서를 맺었다. 이렇듯 우리 나라는 자체개발 뿐 아니라 국제 협의체를 통해, 또는 기업간 협약을 통해 다양한 경로로 백신을 확보할 수 있는 전략을 구상하며 역량을 집중하고 있다.
6. 맺음말
우리는 강보에 싸여 있을 때부터 시작해서 노년까지 수많은 백신을 접종받으며 살고 있다. 말 그대로 ‘요람에서 무덤까지’다. 우리는 그런 백신을 어느 정도 비용만 지불하면 언제든 구할 수 있는 상비약처럼 생각하고 살았지만, 이것은 의료체계가 안정적인 나라의 국민이기에 가능한 일이었다. 하지만 코로나19는 이런 인식을 바꿔놓았다. 우리는 기후변화와 난개발, 교통발달 등으로 인해 신변종 감염병의 끊임없는 출현이 우려되는 상황에 처해 있다. ‘공짜’같은 백신보다는, 우리가 ‘값비싼’ 준비를 해야만 얻을 수 있는 새로운 백신이 더 필요할지 모른다. 그 때를 대비하여 바이러스 및 감염병, 면역학, 백신, 비임상 및 임상 전반에 걸친 연구와 생산시설의 구비, 그리고 각 단계의 전문가 양성까지 이어지는 준비에 만전을 기할 필요가 있다. 이런 준비는 감염병으로부터 건강과 생명뿐 아니라 경제, 그리고 치열한 국제사회 속 주권을 지키기 위해 절실하다. 마스크 속 텁텁한 입김이 아닌 맑은 공기를 마음껏 마실 수 있는 자유가 그리운 지금이다.
※ 해당 콘텐츠는 경제·인문사회연구회의 공식 입장이 아님을 알려드립니다.
